活動実績報告
三木グループ博士課程
京都大学大学院 工学系研究科 合成・生物化学専攻(三木研究室)
博士課程2年(当時) 河村小雪
派遣先:Helmholtz Zentrum München, Marcus Conrad研究室 (ドイツ・ミュンヘン)
渡航期間:2024年7月〜10月
研究課題:細胞内Mg²⁺低下が引き起こす細胞死機構の解明


2024年7月から10月までの3か月間、Helmholtz Zentrum München の Marcus Conrad 研究室に留学しました。Conrad研究室は、プログラム細胞死の1つであるフェロトーシス研究において世界的にリードする研究室です。私はこれまでの研究で、細胞内 Mg2+の低下が細胞死を誘導することを見出しており、その延長線上として今回の留学の機会をいただきました。
滞在中は、細胞死研究で広く用いられるHT-1080細胞を用い、誘導的に細胞内Mg2+を低下させるような細胞株を新たに樹立しました。さらに、ホログラフィック顕微鏡というラベルフリーかつ高倍率・高分解能で観察できる顕微鏡を用い、細胞死のタイムラプスイメージングを行いました。その結果、これまでの顕微鏡観察では捉えきれなかった瞬間的かつダイナミックな形態変化を記録でき、細胞内Mg2+低下が誘導する細胞死が既知の細胞死のいずれにも分類されないユニークな挙動を示すことを明らかにしました。顕微鏡室でConrad先生らとムービーを見て大変議論が盛り上がったことは留学中の大切な思い出の1つです。
この成果を含め、Mg2+低下が誘導するユニークな細胞死とそのメカニズムについて、Conrad研究室の先生方からもご助言いただき、論文投稿に至りました。また、留学先で樹立した細胞を用いてスクリーニング解析も行っており、さらなるメカニズム解明に向けた研究を進めています。
今回の留学では、限られた3ヶ月の中で成果を出さなければならないという強いプレッシャーもありましたが、日々試行錯誤を重ねつつ実験のフットワークを軽く保ち、興味深い結果と共に帰国できたことは、今後の研究活動における大きな自信となりました。
このような機会をサポートいただいた国際先導事業、および受け入れ先のConrad研究室の皆様に改めて感謝申し上げます。
本橋グループ博士課程
博士過程4年(当時) 武田遥奈
所属(当時): 東北大学医学系研究科/東北大学医化学分野(本橋 ほづみ研究室)
派遣先: ダナファーバー癌研究所 癌生物学分野(Edward Chouchani研究室)
研究課題: 獲得免疫機能を制御する新規レドックスセンサーの探索


2024年7月から2025年3月までの9ヶ月間、Dana-Farber Cancer InstituteのEdward Chouchani研究室に留学させていただきました。Edward Chouchani研究室は、システイン残基の修飾を世界最高の解像度で検出するCysteine-reactive phosphate tags(CPT)法を開発し、システイン残基の修飾を網羅的かつ定量的に解析する手法を確立しています。
T細胞は抗原刺激に応答して活性酸素種、特にタンパク質酸化修飾を引き起こす過酸化水素(H₂O₂)を産生し、T細胞の活性化を正に制御することが知られています。そこで私は、ヒトおよびマウスのCD4T細胞、CD8T細胞を用いてCPT法を実施し、抗原刺激によって酸化修飾を受けるタンパク質システイン残基の探索を行うことで、獲得免疫を制御する新たなレドックスセンサーの同定に取り組みました。その結果、多数のシステイン残基の酸化修飾動態が抗原刺激に応答してダイナミックに変動することが明らかとなりました。
現在は、その中でも特に注目されるいくつかのシステイン残基に着目し、変異体を用いた実験などを通じて、酸化修飾の機能的意義の解明に取り組んでいます。将来的には、システイン残基を選択的に修飾する薬剤の開発などを通じて、腫瘍や免疫疾患の治療に繋げていくことを目標としています。さらに、この技術を応用し、超硫黄修飾のプロテオームワイドな解析にも挑戦したいと考えています。
引き続きこれらの研究を遂行するため、派遣期間中にいくつかのフェローシップに応募した結果、ありがたいことにヒューマン・フロンティア・サイエンスプログラム(HFSP)の長期フェローに採択され、今年4月からEdward Chouchani研究室にPostdoctoral Fellowとして着任いたしました。今回の国際先導事業による派遣で得られた成果をさらに発展させていけるよう、今後とも精進してまいります。
改めまして、このような貴重な機会をいただき、誠にありがとうございました。
[業績]
- H. Takeda, et al., “OxiT: A Comprehensive Stoichiometric Landscape of Cysteine Oxidation During T Cell Activation”. Redox Week in Sendai, Sendai, Japan. Apr 2025.
- H. Takeda, et al., “Mediator Complex Subunit 16 (MD16): Its Physiological Role and Redox-dependent Regulations” Gordon Research Seminor/Conference (Thiol-Based Redox Regulation and Signaling), Barcelona, Spain. July 2024.
- 日本学術振興会 育志賞受賞
- Human Frontier Science Program Long-Term Fellowship 採択
中林グループ博士課程
東北⼤学⼤学院薬学研究科 古賀圭祐


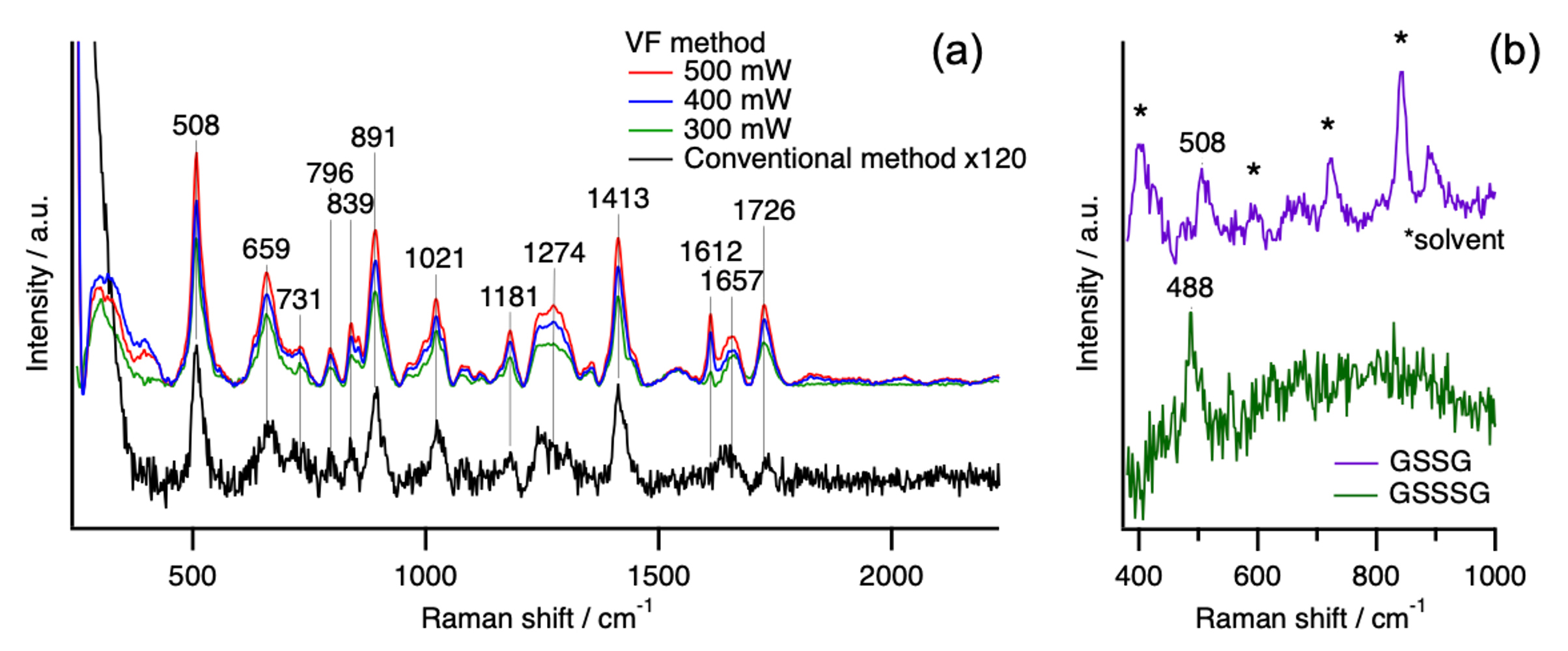
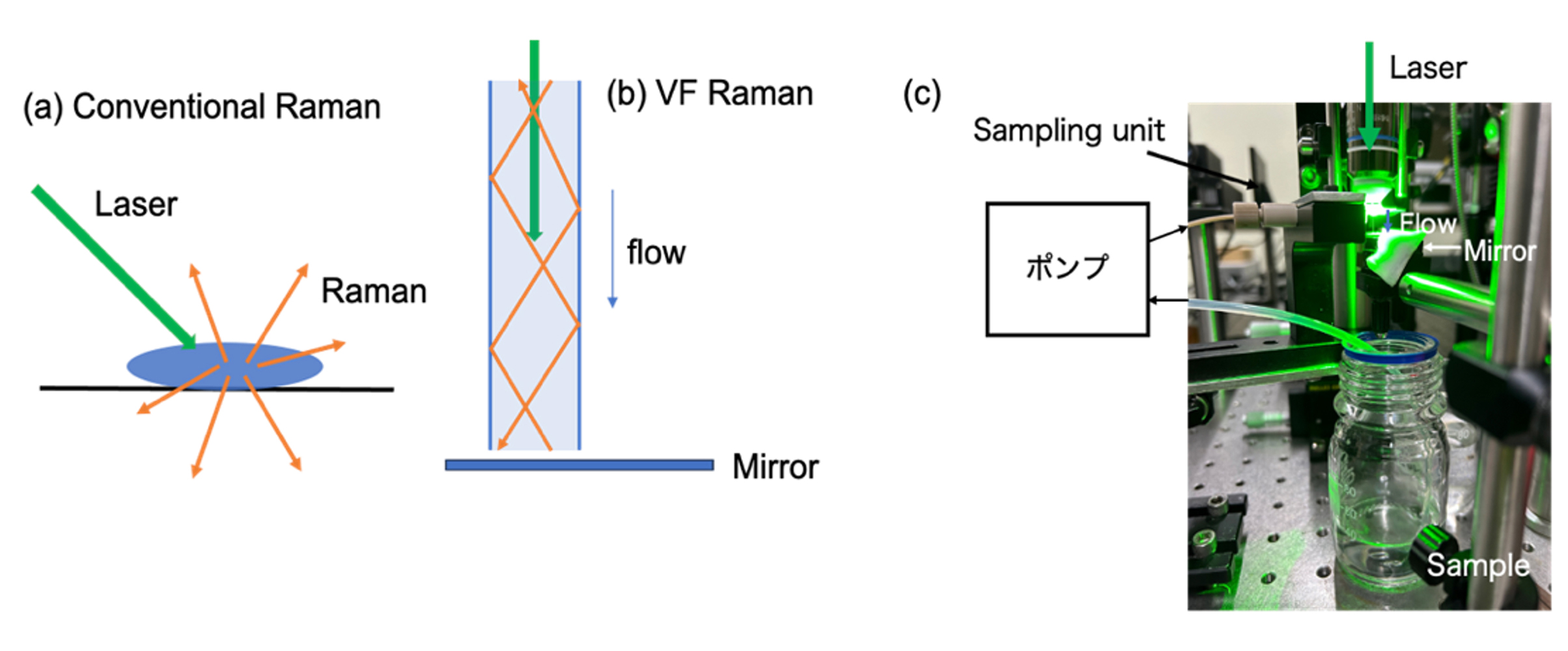
2024年4~6月の約2ヶ月間、台湾の國立陽明交通大學平松博嗣准教授の研究室に留学させて頂き、ラマン分光法を利用した超硫黄化合物の新規検出に関する研究を行いました。特に、ラマン散乱光の高感度検出法であるVertical Flow(VF)法を用いた超硫黄分子の高感度検出とHPLCを組み合わせた高感度HPLC-Raman測定を行いました。VF法は水柱の中で励起光が全反射を繰り返すことで散乱光強度を増加させる方法になります(図1b)。酸化型のグルタチオン(GSSG)水溶液を用いて、増加度の検討を行い、S-S結合のラマン散乱光強度を従来法より約120倍増加させることに成功しました(図2a)。次に、HPLCとVF Ramanを組み合わせたLC-Ramanを用い、GSSGと酸化型グルタチオントリスルフィド(GSSSG)の混合溶液の分離検出を行いました。LC-RamanによりGSSGとGSSSGを分離することができ、それぞれのラマンスペクトルからS-SおよびS-S-S由来のラマンバンドを明確に区別することができました(図2b)。また、ハイパーラマン散乱と呼ばれる新しい手法を用いて硫黄化合物のラマンスペクトルの測定も行いました。
次の実験ではGSSSG以外の超硫黄分子の測定を行い論文にまとめるとともに、Na2S4と有機化合物との反応など、反応性生物としての超硫黄化合物の検出などをLC-Ramanを用いて行っていきます。VF法によるLC-Ramanは他のLC-Ramanよりも高感度であり、超硫黄検出の汎用的な手法となることを目指します。
【講演予定】1. K. Koga, et al., Development of a new detection method for supersulfide molecules using Raman scattering. Redox Week in Sendai 2025.
赤池グループ博士課程
博士課程2年 矢﨑 雅菜
所属:九州大学 農学研究院 有澤研究室
渡航先:ブラウン大学(アメリカ・ロードアイランド州)
受入先:Ming Xian 教授
渡航期間:2024年9月1日〜2024年10月5日
研究課題:酸化還元シグナル伝達分子ドナーの化学合成研究



私は、ブラウン大学 Ming Xian 先生の研究室にて、酸化還元シグナル伝達分子ドナーの化学合成研究に携わりました。具体的には、活性窒素種一酸化窒素 NO および活性硫黄種硫化水素 H2S ドナーとして働くニトロソチオール SNO化合物の分子設計と合成研究を学びました。実際に合成した SNO 化合物は光照射により NO を放出してジスルフィドを生成します。続いて、生じたジスルフィドが様々な化学刺激に応答して H2S を放出します。タイミングを精密に制御しながら NO とH2Sの2種類のシグナル伝達分子を供与するためには有機基部分の分子設計が重要です。加えて、これらのデュアルドナーは、生体内でのNO と H2S の新機能や相互作用の解明に役立つと期待されています。これまでに、私は光応答性化合物を設計や化学修飾を行った経験がなかったので、研究開始当初はシグナル伝達分子を放出させずに単離精製する手法の確立に苦労しました。約1ヶ月の短期間でしたが、Ming 先生や研究室のメンバーとディスカッションを重ね、反応最適条件と精製法を確立して目的物を合成することに成功しました。今回 Ming 研で、目的の機能に合わせて分子設計と化学合成を実施して、機能評価まで行う一連の研究を体験することができ、大変勉強になりました。
私は所属研究室にて、遷移金属触媒を利用するペプチド超硫黄化合物 S–S–S 結合の化学修飾反応の開発を多数行っています。帰国後、留学先での成果を触媒反応開発に活用したいと思い、光照射下に加え、遮光条件で自在に活性種を放出する方法を独自に考案して開発しました。現在反応条件最適化等を実施し、国際誌への論文投稿準備中です。
今回、国際先導事業で短期留学の機会をいただき大変ありがとうございました。博士課程在学中に更に超硫黄化合物の合成研究に関して知見を深めていきます。
魏グループ修士課程
出張者:東北大学大学院 生命科学研究科 修士1年 大久保雄介
期間:2024年9月〜 2025年1月
訪問場所:Yale school of Medicine, Elizabeth研究室


目的: Yale大学医学部内分泌科のElizabeth研にて、ラット肝臓からSMP(Submitochondrial Particle)を遠心分離法を用いて精製する。その後、同大学Jack Zhang助教の研究室にて、クライオ電子顕微鏡単粒子解析法(SPA)とクライオ電子線トモグラフィー法(Cryo-ET)を用いて、精製した試料を観察し、3次元再構成を行う。アデニンヌクレオチド輸送体(ANT)、VDAC、シクロフィリンDをサブユニットとする複合体である、ミトコンドリア透過性遷移孔(mPTP)の分子的正体を構造生物学的な観点から明らかにすることが目的である。
成果:目的タンパクの精製に成功し、クライオ電顕にてデータ取得を行なった。SPAでは計24000枚程度の顕微鏡写真を取得し、Cro-ETでは、115傾斜シリーズのデータを取得した。それらのデータをHDDに保存し、そのHDDを持って帰国した。
業績:SPAによって、分解能3.62ÅのATP合成酵素の3次元再構成に成功した。
今後の展望:mPTPの分子的正体を明らかにするには、現在あるデータを用いて解析を進めていくことが必要である。Cryo-ETに関しても、解析手法に関する勉強・検証が必要であり、今後進めていくつもりである。